Teori Atom Mekanika Kuantum - Kegagalan teori atom Bohr dalam menerangkan spektra atom hidrogen dalam medan
magnet dan medan listrik, mendorong Erwin Schrodinger mengembangkan
teori atom yang didasarkan pada prinsip- prinsip mekanika kuantum.
Teori atom mekanika kuantum mirip dengan yang diajukan oleh model
atom Bohr, yaitu atom memiliki inti bermuatan positif dikelilingi
oleh elektron-elektron bermuatan negatif. Perbedaannya terletak pada
posisi elektron dalam mengelilingi inti atom.


Menurut
Bohr, keberadaan elektron-elektron dalam mengelilingi inti atom
berada dalam orbit dengan jarak tertentu dari inti atom, yang disebut
jari-jari atom (perhatikan Gambar berikut).
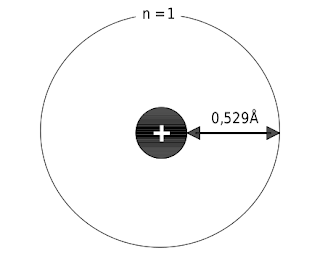 |
| Menurut Bohr, jarak elektron dari inti atom hidrogen adalah 0,529Å. |
Menurut
teori atom mekanika kuantum, posisi elektron dalam mengelilingi inti
atom tidak dapat diketahui secara pasti sesuai prinsip ketidakpastian
Heisenberg. Oleh karena itu, kebolehjadian (peluang) terbesar
ditemukannya elektron berada pada orbit atom tersebut. Dengan kata
lain, orbital adalah daerah kebolehjadian terbesar ditemukannya
elektron dalam atom.
Menurut
model atom mekanika kuantum, gerakan elektron dalam mengelilingi inti
atom memiliki sifat dualisme sebagaimana diajukan oleh de Broglie.
Oleh karena gerakan elektron dalam mengelilingi inti memiliki sifat
seperti gelombang maka persamaan gerak elektron dalam mengelilingi
inti harus terkait dengan fungsi gelombang. Dengan kata lain, energi
gerak (kinetik) elektron harus diungkapkan dalam bentuk persamaan
fungsi gelombang.
Persamaan
yang menyatakan gerakan elektron dalam mengelilingi inti atom
dihubungkan dengan sifat dualisme materi yang diungkapkan dalam
bentuk koordinat Cartesius. Persamaan ini dikenal sebagai persamaan
Schrodinger.
Dari
persamaan Schrodinger ini dihasilkan tiga bilangan kuantum, yaitu
bilangan kuantum utama (n), bilangan kuantum azimut( A ), dan
bilangan kuantum magnetik(m). Ketiga bilangan kuantum ini merupakan
bilangan bulat sederhana yang menunjukkan peluang adanya elektron di
sekeliling inti atom. Penyelesaian persamaan Schrodinger menghasilkan
tiga bilangan kuantum. Orbital diturunkan dari persamaan Schrodinger
sehingga terdapat hubungan antara orbital dan ketiga bilangan kuantum
tersebut.
a. Bilangan Kuantum Utama (n)
Bilangan
kuantum utama (n) memiliki nilai n = 1, 2, 3, ..., n. Bilangan
kuantum ini menyatakan tingkat energi utama elektron dan sebagai
ukuran kebolehjadian ditemukannya elektron dari inti atom. Jadi,
bilangan kuantum utama serupa dengan tingkat-tingkat energi elektron
atau orbit menurut teori atom Bohr. Bilangan kuantum utama merupakan
fungsi jarak yang dihitung dari inti atom (sebagai titik nol). Jadi,
semakin besar nilai n, semakin jauh jaraknya dari inti.
Oleh
karena peluang menemukan elektron dinyatakan dengan orbital maka
dapat dikatakan bahwa orbital berada dalam tingkat-tingkat energi
sesuai dengan bilangan kuantum utama (n). Pada setiap tingkat energi
terdapat
satu
atau lebih bentuk orbital. Semua bentuk orbital ini membentuk kulit
(shell). Kulit adalah kumpulan bentuk orbital dalam bilangan kuantum
utama yang sama.
Kulit-kulit
ini diberi lambang mulai dari K, L, M, N, ..., dan seterusnya.
Hubungan bilangan kuantum utama dengan lambang kulit sebagai berikut.

Jumlah
orbital dalam setiap kulit sama dengan n2 , n adalah
bilangan kuantum utama.
b. Bilangan Kuantum Azimut ( l )
Bilangan
kuantum azimut disebut juga bilangan kuantum momentum sudut,
dilambangkan dengan l . Bilangan kuantum azimut menentukan
bentuk orbital. Nilai bilangan kuantum azimut adalah l = n–1.
Oleh karena nilai n merupakan bilangan bulat dan terkecil sama dengan
satu maka harga l juga merupakan deret bilangan bulat 0, 1,
2, ..., (n–1). Jadi, untuk n=1 hanya ada satu harga bilangan
kuantum azimut, yaitu 0. Berarti, pada kulit K (n=1) hanya terdapat
satu bentuk orbital. Untuk n=2 ada dua harga bilangan kuantum azimut,
yaitu 0 dan 1. Artinya, pada kulit L (n=2) terdapat dua bentuk
orbital, yaitu orbital yang memiliki nilai l =0 dan orbital
yang memiliki nilai l =1.
Bentuk
orbital dengan bilangan kuantum azimut sama dinamakan subkulit. Jadi,
bilangan kuantum azimut dapat juga menunjukkan jumlah subkulit dalam
setiap kulit. Masing-masing subkulit diberi lambang dengan s, p, d,
f, ..., dan seterusnya. Hubungan subkulit dengan lambangnya adalah
sebagai berikut.

c. Bilangan Kuantum Magnetik (m)
Bilangan
kuantum magnetik disebut juga bilangan kuantum orientasi sebab
bilangan kuantum ini menunjukkan orientasi (arah orbital) dalam ruang
atau orientasi subkulit dalam kulit. Nilai bilangan kuantum magnetik
berupa deret bilangan bulat dari –m melalui nol sampai +m. Untuk l
=1, nilai m=0, ±l. Jadi, nilai bilangan kuantum magnetik untuk l
=1 adalah –l melalui 0 sampai +l.
Subkulit-s
( l =0) memiliki harga m=0, artinya subkulit-s hanya memiliki
satu buah orbital. Oleh karena m=0, orbital-s tidak memiliki
orientasi dalam ruang sehingga bentuk orbital-s dikukuhkan berupa
bola yang simetris.
Subkulit-p
( l =1) memiliki nilai m= –1, 0, +1. Artinya, subkulit-p
memiliki tiga buah orientasi dalam ruang (3 orbital), yaitu orientasi
pada sumbu-x dinamakan orbital px, orientasi pada sumbu-y
dinamakan orbital py, dan orientasi pada sumbu-z dinamakan
orbital pz.
Subkulit-d
( l =2) memiliki harga m= –2, –1, 0, +1, +2. Artinya,
subkulit-d memiliki lima buah orientasi dalam ruang (5 orbital),
yaitu pada bidang-xy dinamakan orbital dxy , pada
bidang-xz dinamakan orbital dxz , pada bidang-yz dinamakan
orbital d yz , pada sumbu x2 – y2
dinamakan orbital d x2 - y2 , dan orientasi
pada sumbu z 2 dinamakan orbital dz 2 . Contoh
orientasi orbital dapat dilihat pada Gambar berikut.
 |
| Orientasi orbital pada sumbu y koordinat Cartesius. |
d. Bilangan Kuantum Spin (s)
Di
samping bilangan kuantum n, A , dan m, masih terdapat satu bilangan
kuantum lain. Bilangan kuantum ini dinamakan bilangan kuantum spin,
dilambangkan dengan s. Bilangan kuantum ini ditemukan dari hasil
pengamatan radiasi uap perak yang dilewatkan melalui medan magnet,
oleh Otto Stern dan W. Gerlach.
Pada
medan magnet, berkas cahaya dari uap atom perak terurai menjadi dua
berkas. Satu berkas membelok ke kutub utara magnet dan satu berkas
lagi ke kutub selatan magnet (perhatikan Gambar berikut).
 |
| Penguraian berkas uap atom perak (percobaan Stern-Gerlach) |
Berdasarkan
pengamatan tersebut, disimpulkan bahwa atom-atom perak memiliki sifat
magnet. Pengamatan terhadap atom-atom unsur lain, seperti atom Li,
Na, Cu, dan Au selalu menghasilkan gejala yang serupa. Atom-atom
tersebut memiliki jumlah elektron ganjil. Munculnya sifat magnet dari
berkas uap atom disebabkan oleh spin atau putaran elektron pada
porosnya.
Berdasarkan
percobaan Stern-Gerlach, dapat disimpulkan bahwa ada dua macam spin
elektron yang berlawanan arah dan saling meniadakan. Pada atom yang
jumlah elektronnya ganjil, terdapat sebuah elektron yang spinnya
tidak ada yang meniadakan. Akibatnya, atom tersebut memiliki medan
magnet.
Spin
elektron dinyatakan dengan bilangan kuantum spin. Bilangan kuantum
ini memiliki dua harga yang berlawanan tanda, yaitu + 1/2 dan – 1/2
. Tanda (+) menunjukkan putaran searah jarum jam dan tanda (–) arah
sebaliknya (perhatikan Gambar dibawah). Adapun harga, menyatakan
fraksi elektron.
