Telah diketahui bahwa atom diikat oleh atom lain dalam suatu molekul dengan menggunakan pasangan-pasangan elektron yang berada di atom pusat. Pasangan-pasangan ini mengalami gaya elektrostatis akibat dari muatan yang dimilikinya. Berdasarkan hal tersebut, pada tahun 1970, R.G. Gillesepie mengajukan teori VSEPR (Valance Shell Elektron Pair Repulsion) yang menyatakan bahwa:
“pasangan-pasangan elektron akan berusaha saling menjauhi sehingga tolak-menolak antara pasangan elektron menjadi minimum”
Teori ini juga dikenal sebagai teori jumlah pasangan elektron.
Menurut teori VSEPR, bentuk molekul dapat diramalkan dari jumlah pasangan elektron valensi atom pusat, dan juga posisi pasangan elektron tersebut dalam atom pusat. Di atom pusat pasangan elektron ada pada berbagai posisi, yaitu pasangan elektron bebas-elektron bebas, pasangan elektron bebas-elektron terikat atau pasangan elektron terikat-elektron terikat. Masing-masing pasangan elektron bebas memiliki energi tolakan yang berbeda-beda. Energi tolakan elektron bebas-elektron bebas lebih besar dibandingkan dengan energi tolakan elektron bebas-elektron terikat. Energi tolakan elektron bebas-elektron terikat akan lebih besar dibandingkan dengan energi tolakan elektron terikat-elektron terikat.
Pasangan elektron bebas-elektron bebas > elektron bebas- elektron terikat> elektron terikat-elektron terikat.
1. Perbandingan energi tolakan pasangan elektron
Pada perkembangan lebih lanjut, pengertian domain elektron tidak hanya berlaku untuk ikatan rangkap tetapi termasuk ikatan tunggal. Jika jumlah elektron dalam domain elektron semakin banyak, maka gaya tolak-menolaknya akan semakin besar. Berdasarkan jumlah atomnya, maka urutan gaya tolak-menolak pada domain elektron ikatan adalah sebagai berikut.
Domain elektron ikatan rangkap 3 lebih besar dari domain elektron ikatan rangkap 2, sedangkan domain elektron ikatan 2 lebih besar dibandingkan elektron ikatan tunggal
Berdasarkan kenyataan tersebut dapat diramalkan bentuk molekul dari beberapa senyawa sebagaimana dalam Tabel berikut.

Bentuk
molekul berdasarkan teori domain elektron.
Catatan
:
AXm
En = rumus bentuk molekul, dengan
A :
atom pusat
X :
semua atom yang terikat pada atom pusat
E :
domain elektron bebas
m :
jumlah domain elektron ikatan (DEI)
n :
jumlah domain elektron bebas (DEB)
A* =
aksial
E* =
ekuatorial
Cara
meramalkan bentuk molekul suatu senyawa berdasarkan teori domain
elektron sebagai berikut.
- Tulis struktur Lewis-nya.
- Tentukan jumlah domain elektron di sekitar atom pusat, jumlah domain elektron ikatan (DEI) dan jumlah domain elektron bebas (DEB) dari struktur Lewis.
- Tentukan rumus bentuk molekulnya.
- Bandingkan dengan Tabel diatas
2. Teori hibridisasi
Masih
ingatkah kalian konfigurasi elektron atom C? Konfigurasi elektron
atom C adalah 1s2 2s2 2p2
dan jika dijabarkan satu-satu diperoleh C : 1s2 2s2
2px1 2py1
2pz0 . Elektron valensi terluar adalah
2, maka atom C seharusnya mengikat 2 atom H menjadi CH2 .
Kenyataannya di alam senyawa CH2 tidak ada. Senyawa yang
ada di alam adalah senyawa metana dengan rumus molekul CH4
, mengapa hal itu dapat terjadi?
Berdasarkan
kenyataan yang ada terbukti bahwa atom karbon mengadakan ikatan
kovalen dengan empat atom hidrogen. Dalam senyawa CH4
semua ikatan yang terjadi identik, sudut ikatan antara dua ikatan
adalah 109,5° dengan bentuk geometri molekul tetrahedral (bidang
empat).
Atom
karbon C dapat mengikat 4 atom H menjadi CH4 , maka 1
elektron dari orbital 2s dipromosikan ke orbital 2pz, sehingga
konfigurasi elektron atom C menjadi 1s1 2s1
1px1 1py1
1pz1 . Orbital 2s mempunyai bentuk yang
berbeda dengan ketiga orbital 2p, akan tetapi ternyata kedudukan
keempat ikatan C-H dalam CH 4 adalah sama. Hal ini terjadi
karena pada saat orbital 2s , 2px , 2py
, dan 2pz menerima 4 elektron dari 4 atom H,
keempat orbital ini berubah bentuknya sedemikian sehingga mempunyai
kedudukan yang sama. Peristiwa ini disebut hibridisasi. Dalam senyawa
CH 4 , orbital-orbital hasil hibridisasi merupakan campuran satu
orbital 2s dan tiga orbital 2p, oleh karena itu disebut orbital
hybrid sp3 . Pada senyawa CH4 terbentuk
empat orbital sp3 .
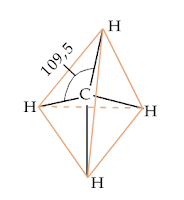
Struktur
tetrahedral senyawa CH4.
Beberapa
bentuk geometri ikatan dapat kalian perhatikan dalam Tabel berikut
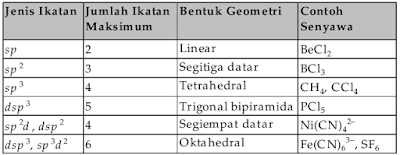
Beberapa
bentuk geometri ikatan.