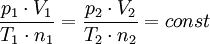A. Pendahuluan
Salah
satu aspek penting dari reaksi kimia adalah hubungan kuantitatif
antara zat-zat yang terlibat dalam reaksi kimia, baik sebagai
pereaksi maupun sebagai hasil reaksi. Jeremias Benjamin Richter
(1762-1807) adalah orang yang pertama kali meletakkan prinsip-prinsip
dasar stoikiometri. Menurutnya stoikiometri adalah ilmu tentang
pengukuran perbandingan kuantitatif atau pengukuran perbandingan
antar unsur kimia yang satu dengan yang lain dinyatakan dalam
hukum-hukum dasar kimia.
B. Hukum Kekekalan Massa (Hukum Lavoisier)
Pada
tahun 1774 Lavoisier memanaskan timah dengan oksigen dalam suatu
wadah tertutup. Dengan menggunakan neraca dan penimbangan yang teliti
ia berhasil membuktikan bahwa massa sistem tidak berubah meskipun
timah telah bereaksi dengan oksigen menghasilkan serbuk berwarna
putih. Ia menemukan keteraturan dari hasil pengamatannya sebagai
Hukum Kekekalan Massa.
Hukum
yang ditemukan berdasarkan pada penelitian yang dilakukan oleh
Lavoisier tersebut berbunyi :
“Pada
setiap reaksi kimia, massa zat-zat yang bereaksi adalah sama dengan
massa zat- zat hasil reaksi”
Pernahkah
Anda memperhatikan sepotong besi yang dibiarkan di udara terbuka, dan
pada suatu waktu kita akan menemukan, bahwa besi itu telah berubah
menjadi karat besi. Jika kita timbang massa besi sebelum berkarat
dengan karat besi yang dihasilkan, ternyata massa karat besi lebih
besar. Benarkah demikian?
Dari
kejadian tersebut, kita mendapatkan gambaran bahwa seolah-olah dalam
suatu reaksi kimia, ada perbedaan massa zat, sebelum dan sesudah
reaksi, sesuai dengan hukum kekekalan massa. Hukum kekekalan massa,
dalam menyetarakan persamaan reaksi, artinya massa zat sebelum reaksi
sama dengan massa sesudah reaksi.
C. Hukum Perbandingan Tetap (Hukum Proust)
Joseph
Louis Proust pada tahun 1797 melakukan sederetan percobaan mengenai
perbandingan jumlah zat-zat yang bereaksi. Misalnya pada pembentukan
senyawa natrium klorida dari unsur-unsurnya, perbandingan jumlah
natrium dan klor dalam suatu reaksi selalu tetap, yaitu 39,0% natrium
dan 61% klor. Demikian pula untuk reaksi kimia yang lain.
Tabel
1. Hasil Eksperimen Proust
Massa Hidrogen
yang direaksikan (gram)
|
Massa Oksigen
yang direaksikan (gram)
|
Massa Air yag
terbentuk (gram)
|
Sisa Hidrogen
atau Oksigen (gram)
|
1
|
8
|
9
|
-
|
2
|
8
|
9
|
1 gram hidrogen
|
1
|
9
|
9
|
1 gram oksigen
|
2
|
16
|
18
|
-
|
Dari
tabel di atas terlihat, bahwa setiap 1 gram gas hidrogen bereaksi
dengan 8 gram oksigen, menghasilkan 9 gram air. Hal ini membuktikan
bahwa massa hidrogen dan massa oksigen yang terkandung dalam air
memiliki perbandingan yang tetap yaitu 1 : 8, berapapun banyaknya air
yang terbentuk.
Dari
percobaan yang dilakukannya, Proust mengemukakan teorinya yang
terkenal dengan sebutan, Hukum Perbandingan Tetap, yang berbunyi:
“Perbandingan
massa unsur-unsur penyusun suatu senyawa selalu tetap”
Penyimpangan Hukum Proust
Hukum Proust merupakan hukum yang amat berguna pada pembahasan
stoikiometri, tetapi perlu diketahui bahwa sekalipun hukum ini amat
berguna dalam dasar-dasar kimia modern, hukum perbandingan tetap
tidak selalu berlaku untuk semua senyawa.
Hukum Proust tidak berlaku untuk senyawa-senyawa yang mengandung
komposisi isotop yang berbeda. Komposisi isotop dapat berbeda sesuai
sumber dari unsur yang membentuk senyawa tersebut. Selain itu, hukum
Proust juga tidak berlaku pada polimer, baik polimer alami maupun
polimer buatan.
Dalton menyelidiki perbandingan unsur-unsur tersebut pada setiap
senyawa dan didapatkan suatu pola keteraturan. Pola tersebut
dinyatakan sebagai hukum Perbandingan Berganda yang bunyinya:
“Bila
dua unsur membentuk lebih dari satu senyawa, dimana massa salah satu
unsur tetap (sama), maka perbandingan massa unsur yang lainnya
merupakan bilangan bulat dan sederhana”
Perbandingan atom unsur-unsur dalam suatu rumus kimia ditunjukkan
dengan angka yang bulat, dan bukan dengan angka pecahan. Sebagai
contoh, karbon monoksida (CO) mempunyai perbandingan antara atom C
dan atom O sama dengan 1 : 1, yang berarti perbandingan atom untuk
membuat 1 molekul CO tanpa ada sisa atom C atau atom O kita harus
mengambil 1 atom C dan 1 atom O sesuai dengan perbandingan atom-atom
dalam rumus kimia senyawanya.
D. Hukum Perbandingan Berganda (Hukum Dalton)
John Dalton pertama kali mengemukakan pengamatan ini pada 1803.
Beberapa tahun sebelumnya, kimiawan Perancis telah mengemukakan hukum
perbandingan tetap. Dalton merumuskan hukum ini berdasarkan
pengamatan-pengamatan terhadap nilai- nilai perbandingan Proust.
Kedua hukum ini merupakan penemuan penting untuk menjelaskan
bagaimana senyawa terbentuk dari atom-atom.
Tabel 2. Perbandingan Berganda
Unsur pembentuk
senyawa
|
Rumus
|
Perbandingan massa per senyawa
|
Perbandingan massa unsur dalam kedua senyawa
|
H dan O
|
H2O
H2O2
|
H:O = 2:16
H:O = 2: 32
|
16:32 = 1:2
|
C dan O
|
CO
CO2
|
C:O = 12:16
C:O = 12:32
|
16:32 = 1:2
|
E. Hukum Boyle-Gay Lussac
Hukum ini merupakan perluasan hukum terdahulu dan diturunkan dengan
keadaan
harga n1 = n2 sehingga diperoleh persamaan :
P 1 . V 1/ T 1 = P 2 .
V 2 / T 2
F. Hukum Avogadro (Hipotesis Avogadro atau Prinsip Avogadro)
Seorang ahli fisika dari Italia bernama Amadeo Avogadro berpendapat
bahwa ada hubungan antara jumlah partikel dalam gas dan volume gas,
yang tidak bergantung pada jenis gas.
Untuk memahaminya, perhatikan data percobaan penentuan jumlah molekul
beberapa gas pada volum 1L, suhu dan tekanan standar (0°C, 76 cmHg)
pada tabel di bawah ini :
Tabel 3. Data percobaan pengukuran volume pada suhu dan tekanan
standar
Nama
|
Massa (gram)
|
Volume (L)
|
Jumlah Molekul
|
Oksigen
|
1,460
|
1
|
2,688 x 1022
|
Nitrogen
|
1,250
|
1
|
2,688 x 1022
|
Karbon Dioksida
|
1,961
|
1
|
2,688 x 1022
|
Dari data tersebut ternyata dalam volum yang sama dan keadaan yang
sama terdapat jumlah partikel yang sama pula. Artinya, jumlah molekul
atau atom dalam suatu volum gas tidak tergantung kepada
ukuran dari molekul gas. Sebagai Contoh :
1 liter gas hidrogen dan nitrogen akan mengandung jumlah molekul yang
sama, selama suhu dan tekanannya sama. Aspek ini dapat dinyatakan
secara matematis :
Dimana:
V adalah volume gas.
n adalah jumlah mol dalam gas tersebut.
k adalah tetapan kesebandingan.
Akibat paling penting dari hukum Avogadro adalah bahwa Konstanta gas
ideal memiliki nilai yang sama bagi semua gas. Artinya, konstan.
Dimana:
p adalah tekanan gas
T adalah temperatur
V adalah volume
N adalah jumlah mol
Satu mol gas ideal memiliki volum 22.4 Liter pada kondisi standar
(STP), dan angka ini sering disebut volum molar gas ideal. Gas-gas
nyata (non-ideal) memiliki nilai yang berbeda. Hipotesis Avogadro
dijadikan suatu hukum, yang dikenal sebagai Hukum Avogadro. Hipotesis
Avogadro berbunyi :
“Gas-gas
yang memiliki volum yang sama, pada temperatur dan tekanan yang sama,
memiliki jumlah partikel yang sama pula.”