Konfigurasi elektron berdasarkan konsep kulit atom, yaitu jumlah elektron yang mengisi pada tiap kulit dan dikenal sebagai periode. Pada mekanika gelombang atau mekanika kuantum, elektron-elektron dalam suatu atom akan tersebar ke dalam orbital-orbital (s, p, d, f, dan seterusnya). Bagaimana pengisian elektron ke dalam orbital? Pengisian orbital oleh elektron mengikuti aturan dengan memperhatikan tiga hal, yaitu asas AufBau, asas larangan Pauli, dan asas Hund.
1. Asas AufBau
Menurut asas AufBau, pada kondisi normal atau pada tingkat dasar, elektron akan menempati orbital yang memiliki energi terendah terlebih dahulu dan diteruskan ke orbital yang memiliki energi lebih tinggi. Untuk memudahkan dalam pengisian elektron diberikan tahap-tahap pengisian elektron dengan menggunakan jembatan ingatan sebagai berikut.

Urutan pengisian elektron ke dalam orbital.
Arah anak panah menyatakan urutan pengisian orbital. Dengan demikian urutan pengisian elektron berdasarkan gambar tersebut berurut-urut 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, dan seterusnya. Pengisian elektron harus satu persatu dan setiap orbital hanya boleh diisi oleh maksimal 2 elektron.
Contoh:
Bagaimana konfigurasi elektron dari unsur H, He, N, dan Sc?
(No atom H = 1, He = 2, N = 7, dan Sc = 21)
Jawab
1 H
: 1s1
2 He
: 1s2
7 N
: 1s2
2s2 2p3
21
Sc : 1s2 2s2 2p6
3s2 3p6 4s2 3d1
2. Asas larangan Pauli
Pauli mengemukakan hipotesisnya yang menyatakan bahwa dalam satu atom tidak mungkin dua elektron mempunyai keempat bilangan kuantum sama. Misal, 2 elektron akan menempati subkulit 1s. Tiga bilangan kuantum pertama akan mempunyai nilai yang sama (n = 1, l = 0, m = 0). Untuk itu bilangan kuantum yang terakhir, yaitu bilangan kuantum spin(s) harus mempunyai nilai berbeda ( + 1/2 atau -1/2 ).
Dengan kata lain, setiap orbital maksimal hanya dapat terisi 2 elektron dengan arah spin berlawanan. Sebagai contoh, pengisian elektron pada orbital 1s digambarkan sebagai berikut.
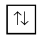
Mengapa pada satu orbital hanya dapat ditempati maksimal oleh dua elektron? Karena jika ada elektron ketiga, maka elektron tersebut pasti akan mempunyai spin yang sama dengan salah satu elektron yang terdahulu dan itu akan melanggar asas larangan Pauli dengan demikian tidak dibenarkan. Jumlah elektron maksimal untuk tiap subkulit sama dengan dua kali dari jumlah orbitalnya.
- orbital s maksimal 2 elektron
- orbital p maksimal 6 elektron
- orbital d maksimal 10 elektron, dan
- orbital f maksimal 14 elektron.
3. Asas Hund
Frederick Hund, 1927 (dikenal Hund) mengatakan bahwa pengisian elektron pada orbital yang setingkat (energinya sama) dalam satu orbital adalah satu per satu dengan arah spin yang sama sebelum berpasangan. Asas ini dikemukakan berdasarkan penalaran bahwa energi tolak-menolak antara dua elektron akan minimum jika jarak antara elektron berjauhan. Untuk lebih memahaminya, perhatikan gambaran pengisian elektron pada orbital p.
Contoh pengisian yang benar.
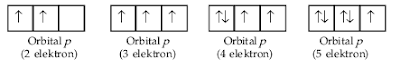
Contoh pengisian yang salah.

Untuk penulisan konfigurasi elektron yang mempunyai jumlah elektron besar dapat dilakukan penyederhanaan. Penyederhanaan dilakukan dengan menuliskan simbol dari unsur gas mulia yang mempunyai nomor atom di bawahnya, diikuti dengan penulisan kekurangan jumlah elektron setelah gas mulia tersebut.
Contoh:
Perhatikan konfigurasi elektron unsur-unsur dibawah ini.
a. 10Ne
: 1s2 2s2
2p6
b.11Na
: 1s2 2s2
2p6 3s1
c. 8Ar
: 1s2 2s2 2p6 3s2 3p6
d. 20C
a : 1s2 2s2 2p6 3s2 3p6
4s2
e. 25Mn
: 1s2 2s2 2p6 3s2 3p6
3d5 4s2
Sederhanakan penulisan konfigurasi elektron tersebut.
Jawab :
Penulisan konfigurasi elektron Na, Ca, dan Mn tersebut dapat disederhanakan menjadi
11
Na : [Ne] 3s1
20
C a : [Ar] 4s2
25Mn
: [Ar] 4s2 3d5